Conception rationnelle d’inhibiteurs de carbapénèmases pour le traitement de la résistance aux antibiotiques
Mécanismes de résistance aux antibiotiques et relevance clinique
Les quatre principaux mécanismes de résistance aux antibiotiques sont :
- Inactivation de l’antibiotique par voie enzymatique, en présence de β-lactamases
- Perméabilité diminuée pour la pénétration de l’antibiotique dans la bactérie, par la réduction du nombre de porines
- Modification de la cible de l’antibiotique, par la modification des transpeptidases de la paroi bactérienne
- Rejet de l’antibiotique, à travers des pompes à efflux à large spécificité
Parmi ces quatre mécanismes, le premier est le plus important et pose des problèmes énormes actuellement en milieu clinique. Ceci nous a conduit à démarrer, dans le cadre du Laboratoire d’Excellence en Recherche sur le Médicament et l’Innovation Thérapeutique (LabEx LERMIT) en collaboration avec Thierry Naas (Hôpital Bicêtre et Centre National de Référence de la Résistance aux Antibiotiques) et plusieurs équipes de chimistes du sud parisien, un projet ayant comme but le design rationnel de nouveaux inhibiteurs de β-lactamases (et plus particulièrement de carbapénèmases) pour le traitement de la résistance aux antibiotiques.
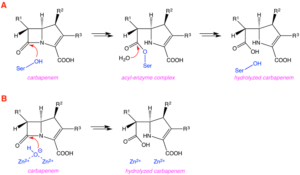
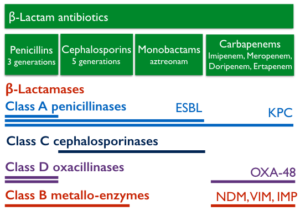
Les bactéries multi-résistantes à Gram-négatif, et particulièrement les entérobactéries productrices de carbapénèmases, émergent à l’échelle mondiale. Les β-lactamines, du fait de la bonne tolérance et de l’efficacité clinique, sont les antibiotiques les plus prescrits pour traiter des infections bactériennes. Cependant, leur utilisation est menacée par la dissémination mondiale de β-lactamases capables de les hydrolyser, tout particulièrement chez les bactéries multi-résistantes à Gram-négatif. Ces β-lactamases sont divisées en 4 classes moléculaires : les classes A, C and D, avec un résidu serine dans le site actif (serine-β-lactamases), et la classe B, avec deux ions zinc dans le site actif (métallo-β-lactamases). Actuellement, la résistance médiée par les β-lactamases n’épargne pas les dernières générations de β-lactamines possédant le spectre d’activité le plus large : les carbapénèmes.
Les principales familles d’antibiotiques de type β-lactame sont les pénicillines, les céphalosporines, les monobactames et les carbapénèmes. L’activité antibiotique des β-lactames est obtenue par l’inhibition des transpeptidases (connues également sous le nom de protéines liant la pénicilline – PLPs), qui jouent un rôle essentiel dans la formation de la paroi bactérienne. Ces antibiotiques sont hydrolysés par des β-lactamases, chaque classe de β-lactamases ayant un profil d’hydrolyse spécifique (généralement assez restreint) par rapport aux différentes familles de β-lactames. Cependant, nous assistons actuellement à l’apparition de β-lactamases capables d’hydrolyser plusieurs familles d’antibiotiques, et même les carbapénèmes, qui sont considérés comme des antibiotiques de dernier recours, utilisés notamment dans des unités de soins intensifs. Ces nouvelles β-lactamases sont les carbapénèmases. Le but de notre projet est de développer des inhibiteurs originaux et efficaces des β-lactamases, et notamment des carbapénèmases, afin de restaurer l’activité antibiotique des β-lactames.
Design rationnel d’inhibiteurs de carbapénèmases
Dans ce contexte, nous développons actuellement plusieurs séries d’inhibiteurs avec des structures originales ayant des très bonnes activités sur multiples classes de carbapénèmases. Ce developpement a bénéficié d’un financement de pré-maturation de la Fondation de Coopération Scientifique Campus Paris-Saclay et est actuellement en cours de maturation soutenu par la SATT Paris-Saclay (projet CarbaMAT).
Détermination de structures de β-lactamases par diffraction de rayons X et étude de l’interaction avec des substrats par modélisation moléculaire
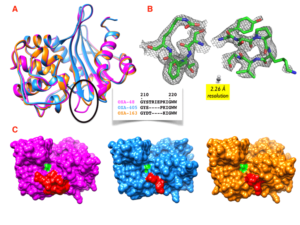
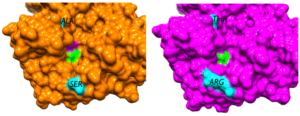
Nous avons obtenu récemment la structure de rayons X de la carbapénèmases OXA-405 (PDB 5FDH), avec une résolution de 2,26 Å. La structure tridimensionnelle est similaire à celles de OXA-48 et OXA-163, à l’exception de la boucle β5-β6 dans laquelle il y a une délétion de 4 résidus. Cette délétion induit une ouverture du site actif à son extrémité, qui a pour conséquence l’hydrolyse des céphalosporines en plus des substrats habituels de l’OXA-48.
Des calculs de docking covalent ont permis d’expliquer cette modification du profil d’hydrolyse pour OXA-405. Des simulations de dynamique moléculaire suivies d’une analyse avec le logiciel HOP, en utilisant la technique de « water mapping », ont permis d’identifier les molécules d’eau stabilisées sur la surface de la structure OXA-405.
Nous avons également obtenu la structure de rayons X de la carbapénèmase OXA-232 (PDB 5HFO), avec une résolution de 2,21 Å. La structure globale est conservée par rapport à celle de OXA-48, à l’exception des 5 résidus mutés. Des calculs de docking covalent ont été réalisés afin d’expliquer les changements importants induits par les mutations dans le profil d’hydrolyse de l’OXA-232 par rapport à OXA-48.
Revues :
- Naas, T. ; Dortet, L. ; Iorga, B. I., Structural and functional aspects of class A carbapenemases. Curr. Drug Targets 2016, 17, 1006-1028 [Version en ligne] (Open Access).
Actes de congrès :
- Dabos, L. ; Bonnin, R. A. ; Dortet, L. ; Naas, T. ; Iorga, B. I. Key role of the β5-β6 loop conformation in the substrate specificity of OXA-48–like enzymes : Implications for the β-lactamase-mediated antibiotic resistance, 253rd ACS National Meeting & Exposition Abstracts of Papers, 2017 ; pp COMP-582.
- Iorga, B. ; Retailleau, P. ; Marchini, L. ; Oueslati, S. ; Dortet, L. ; Naas, T. Molecular modeling of OXA-405, a new member of the OXA-48 carbapenemase family, 251st ACS National Meeting & Exposition Abstracts of Papers, American Chemical Society : 2016 ; pp COMP-123.
- Naas, T. ; Oueslati, S. ; Cissé, C. ; Retailleau, P. ; Iorga, B. I. Insights into the selectivity profile of OXA-232 carbapenemase using covalent docking and molecular dynamics simulations, 248th ACS National Meeting & Exposition Abstracts of Papers, San Francisco, CA, USA, August 10-14 ; American Chemical Society : San Francisco, CA, USA, 2014 ; pp COMP-518.
- Naas, T. ; Nordmann, P. ; Iorga, B. I. Molecular modeling studies in beta-lactamase-mediated antibiotic resistance, 245th ACS National Meeting & Exposition Abstracts of Papers, New Orleans, LA, United States, American Chemical Society : New Orleans, LA, United States, 2013 ; pp BIOL-222.
- Naas, T. ; Brozek, C. ; Bernadat, G. ; Beckstein, O. ; Nordmann, P. ; Iorga, B. I. Interaction of avibactam with OXA-48 and KPC-2 carbapenemases accounts for its unique efficiency in the treatment of antibiotic resistance, 244th ACS National Meeting & Exposition Abstracts of Papers, Philadelphia, PA, United States, August 19-23 ; American Chemical Society : Philadelphia, PA, United States, 2012 ; pp COMP-463.
Etude de l’interaction des récepteurs nicotiniques de l’acétylcholine avec des toxines de type spiroimine
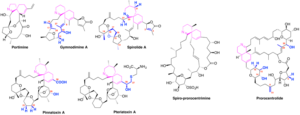
Les phycotoxines macrocycliques de type spiroimine constituent une classe émergeante de composés associés à la toxicité des fruits de mer. Les membres représentatifs de cette famille sont les gymnodimines, les spirolides, les pinnatoxines, les pteriatoxines, la portimine et la spiro-prorocentrimine. Un autre membre de la famille des imines cycliques est la prorocentrolide. Ces composés sont des puissants antagonistes des récepteurs nicotiniques de l’acétylcholine (nAChRs), ce qui a motivé le développement de nouveaux outils pour la détection de ces toxines dans les fruits de mer et le design de nouvelles molécules d’intérêt thérapeutique.
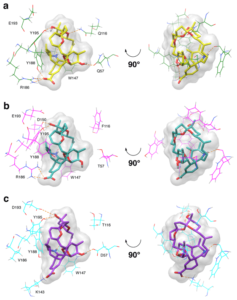
Nous étudions l’interaction des toxines de la famille des spiroimines avec l’Acetylcholine Binding Protein (AChBP), qui est un analogue soluble du domaine extracellulaire des nAChRs, et avec différents sous-types de nAChRs (construits par homologie avec l’AChBP) afin d’identifier les bases moléculaires de la sélectivité déterminée expérimentalement et de guider la synthèse de dérivés des ces toxines afin d’obtenir une meilleure sélectivité pour chaque sous-type de nAChRs. Pendant le déroulement du projet, les structures de rayons X de l’AChBP en complexe avec gymnodimine A, 13-desméthyl spirolide C et pinnatoxines A et G ont été publiées, confirmant les modes de d’interaction que nous avions trouvé précédemment par docking. Une des nos figures a été sélectionnée pour la couverture du numéro correspondant du Toxicol. Sci.
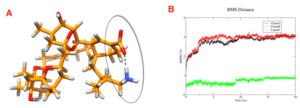
Actuellement, aucun logiciel de docking n’est capable de réaliser directement le docking flexible de macrocycles, étape essentielle dans ce projet. Nous avons donc utilisé une procédure en deux étapes : i) un ensemble de conformères du macrocycle a été généré par une recherche conformationnelle (MacroModel) ; ii) cet ensemble a été utilisé pour le docking (Gold) dans le site de fixation de l’AChBP et des sous types de nAChRs, les chaines latérales de quelques résidus clé présents dans le site étant flexibles pendant le docking. De cette manière, la flexibilité a été introduite à la fois au niveau du ligand et du le récepteur. Les meilleures poses de docking ont été ensuite utilisées dans des simulation de dynamique moléculaire (Gromacs, champ de force OPLS-AA) des complexes récepteur-ligand.
Articles :
- Couesnon, A. ; Aráoz, R. ; Iorga, B. I. ; Benoit, E. ; Reynaud, M. ; Servent, D. ; Molgó, J., The dinoflagellate toxin 20-methyl spirolide-G potently blocks skeletal muscle and neuronal nicotinic acetylcholine receptors. Toxins 2016, 8, 249 [Version en ligne].
- Aráoz, R. ; Ouanounou, G. ; Iorga, B. I. ; Goudet, A. ; Alili, D. ; Amar, M. ; Benoit, E. ; Molgó, J. ; Servent, D., The neurotoxic effect of 13,19-didesmethyl and 13-desmethyl spirolide C phycotoxins is mainly mediated by nicotinic rather than muscarinic acetylcholine receptors. Toxicol. Sci. 2015, 147, 156-167 [Version en ligne].
- Jackson, J. J. ; Stivala, C. E. ; Iorga, B. I. ; Molgó, J. ; Zakarian, A., Stability of cyclic imine toxins : Interconversion of pinnatoxin amino ketone and pinnatoxin A in aqueous media. J. Org. Chem. 2012, 77, 10435-10440 [Version en ligne].
- Aráoz, R. ; Servent, D. ; Molgó, J. ; Iorga, B. I. ; Fruchart-Gaillard, C. ; Benoit, E. ; Gu, Z. ; Stivala, C. ; Zakarian, A., Total synthesis of pinnatoxins A and G and revision of the mode of action of pinnatoxin A. J. Am. Chem. Soc. 2011, 133, 10499-10511 [Version en ligne].
Chapitres de livre :
- Molgó, J. ; Benoit, E. ; Aráoz, R. ; Zakarian, A. ; Iorga, B. I., Spirolides and cyclic imines : Toxicological profile. In Marine and Freshwater Toxins, Gopalakrishnakone, P. ; Haddad Jr, V. ; Kem, W. R. ; Tubaro, A. ; Kim, E., Eds. Springer Netherlands : 2015 ; pp 193-217 [Version en ligne].
- Molgó, J. ; Aráoz, R. ; Iorga, B. I. ; Benoit, E. ; Zakarian, A., Cyclic imine neurotoxins acting on muscarinic and nicotinic acetylcholine receptors. In Toxins and biologically active compounds from microalgae, Rossini, G. P., Ed. CRC Press : Boca Raton, FL, 2014 ; Vol. 2, pp 116-146 [Version en ligne].
- Molgó, J. ; Aráoz, R. ; Benoit, E. ; Iorga, B. I., Cyclic imine toxins : chemistry, origin, metabolism, pharmacology, toxicology, and detection. In Seafood and freshwater toxins. Pharmacology physiology and detection. 3rd ed., Botana, L. M., Ed. CRC Press : 2014 ; pp 951-990 [Version en ligne].
Revues :
- Molgó, J. ; Aráoz, R. ; Benoit, E. ; Iorga, B. I., Physical and virtual screening methods for marine toxins and drug discovery targeting nicotinic acetylcholine receptors. Exp. Opin. Drug Discov. 2013, 8, 1203-1223 [Version en ligne].
Actes de congrès :
- Iorga, B. I. ; Aráoz, R. ; Benoit, E. ; Molgó, J., Selectivity of spiroimine phycotoxins toward nicotinic acetylcholine receptors. Biophys. J. 2016, 110, 603a [Version en ligne].
- Aráoz, R. ; Benoit, E. ; Molgó, J. ; Iorga, B. I., Conformational flexibility of cyclic imine phycotoxins revealed by long-timescale molecular dynamics simulations. Toxicon 2014, 91, 179 [Version en ligne].
- Aráoz, R. ; Benoit, E. ; Molgó, J. ; Iorga, B. I. Understanding selectivity of macrocyclic spiroimine phycotoxins toward nicotinic acetylcholine receptors using ligand- and structure-based molecular modeling methods, 248th ACS National Meeting & Exposition Abstracts of Papers, San Francisco, CA, USA, August 10-14 ; American Chemical Society : San Francisco, CA, USA, 2014 ; pp COMP-223.
- Aráoz, R. ; Benoit, E. ; Molgó, J. ; Iorga, B. I. Conformational flexibility of cyclic imine phycotoxins revealed by long-timescale molecular dynamics simulations, 247th ACS National Meeting & Exposition Abstracts of Papers, Dallas, TX, United States, American Chemical Society : Dallas, TX, United States, 2014 ; pp COMP-93.
- Aráoz, R. ; Molgó, J. ; Iorga, B. I., Conformational and pharmacophoric features within the cyclic imine phycotoxin group. Toxicon 2013, 75, 218 [Version en ligne].
- Aráoz, R. ; Molgó, J. ; Iorga, B. I. Conformational and pharmacophoric features within the macrocyclic spiroimine toxins family, 245th ACS National Meeting & Exposition Abstracts of Papers, New Orleans, LA, United States, American Chemical Society : New Orleans, LA, United States, 2013 ; pp COMP-47.
- Aráoz, R. ; Zakarian, A. ; Molgó, J. ; Iorga, B. I., Insights into the interaction of pinnatoxin A with nicotinic acetylcholine receptors using molecular modeling. In Toxins and ion tranfers, Barbier, J. ; Benoit, E. ; Gilles, N. ; Ladant, D. ; Martin-Eauclaire, M.-F. ; Mattei, C. ; Molgó, J. ; Popoff, M. R. ; Servent, D., Eds. French Society of Toxinology : Paris, 2011 ; pp 49-54.
- Aráoz, R. ; Servent, D. ; Molgó, J. ; Iorga, B. I. ; Fruchart-Gaillard, C. ; Benoit, E. ; Gu, Z. ; Stivala, C. ; Zakarian, A., Pinnatoxins : an emergent family of marine phycotoxins targeting nicotinic acetylcholine receptors with high affinity. In Toxins and ion tranfers, Barbier, J. ; Benoit, E. ; Gilles, N. ; Ladant, D. ; Martin-Eauclaire, M.-F. ; Mattei, C. ; Molgó, J. ; Popoff, M. R. ; Servent, D., Eds. French Society of Toxinology : Paris, 2011 ; pp 43-47.
- Aráoz, R. ; Chabaud, L. ; Guillou, C. ; Molgó, J. ; Iorga, B. I., Spiroimine toxins in complex with nicotinic acetylcholine receptors : Structure and dynamics. Biophys. J. 2011, 100, 347a (1881) [Version en ligne].
- Aráoz, R. ; Chabaud, L. ; Guillou, C. ; Molgó, J. ; Iorga, B. I., Molecular dynamics studies of Acetylcholine Binding Protein with spiroimine toxins. In Advances and New Technologies in Toxinology, Barbier, J. ; Benoit, E. ; Marchot, P. ; Mattei, C. ; Servent, D., Eds. French Society of Toxinology : Paris, 2010 ; pp 109-114.