Compte tenu de leurs activités biologiques importantes, de leur faible biodisponibilité et de leur complexité structurelle, l’accès aux glycostructures est un défi majeur en chimie organique. La glycosylation est une modification présente dans de nombreuses molécules naturelles et dans plus de la moitié des protéines. Il s’agit de faire réagir un accepteur de glycosyle sur un donneur de glycosyle en utilisant un promoteur qui active le départ d’un groupe partant dans les conditions appropriées (solvant, température, pression) pour former un acétal, créant de manière sélective une liaison a ou b.
Méthodologies en glycosylation
La glycosylation utilisant directement la b-N-acétyl-D-glucosamine peracétylée a été décrite par notre équipe en présence d’une quantité catalytique de triflate de fer (III) sous irradiation par micro-ondes (A). La réaction a également été réalisée en flux continu, une technique qui présente de nombreux avantages et qui permet de résoudre les problèmes de montée en échelle liés aux micro-ondes.

Nous avons également mis au point une nouvelle méthode d’activation de glycosylsulfone (B) en présence de triflate de scandium (70 mol-%) sous activation micro-ondes. La réaction a été particulièrement efficace pour l’a-mannosylation sans groupe participant, conduisant aux adduits de glycosylation correspondants avec de bons rendements.
Synthèse totale de biomolécules et d’analogues
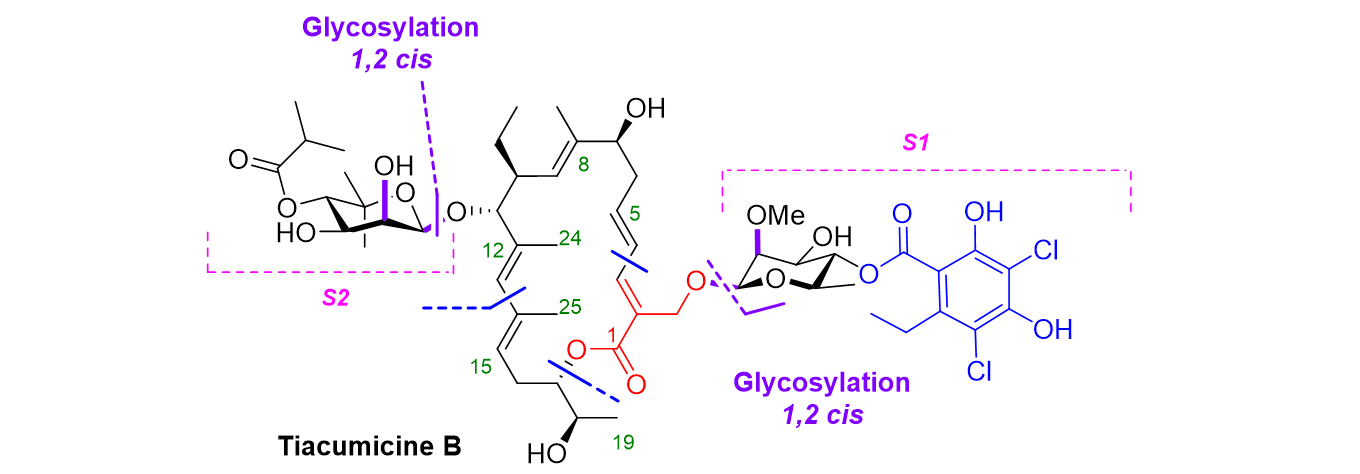
Synthèse totale de la tiacumicine B, un antibiotique naturel
La résistance des bactéries aux antibiotiques est un réel problème de santé publique et l’une des solutions pour lutter contre la résistance consiste à développer de nouvelles molécules, éventuellement en interaction avec de nouvelles cibles biologiques.
C’est le cas de la tiacumicine B, un antibiotique naturel qui a été approuvé par la FDA en 2011 aux États-Unis pour le traitement de la diarrhée nosocomiale associée à Clostridium difficile. Ce projet est réalisé en collaboration avec le Dr E. Roulland (Université de Paris-Descartes), responsable de la synthèse du noyau macrolactonique de la molécule. Notre équipe développe la chimie des sucres pour l’élaboration des fragments rhamnoside (S1) et novioside (S2), ainsi que des glycosylations 1,2-cis nécessaires pour les relier à l’aglycone.
Synthèse de molécules impliquées dans la croissance végétale
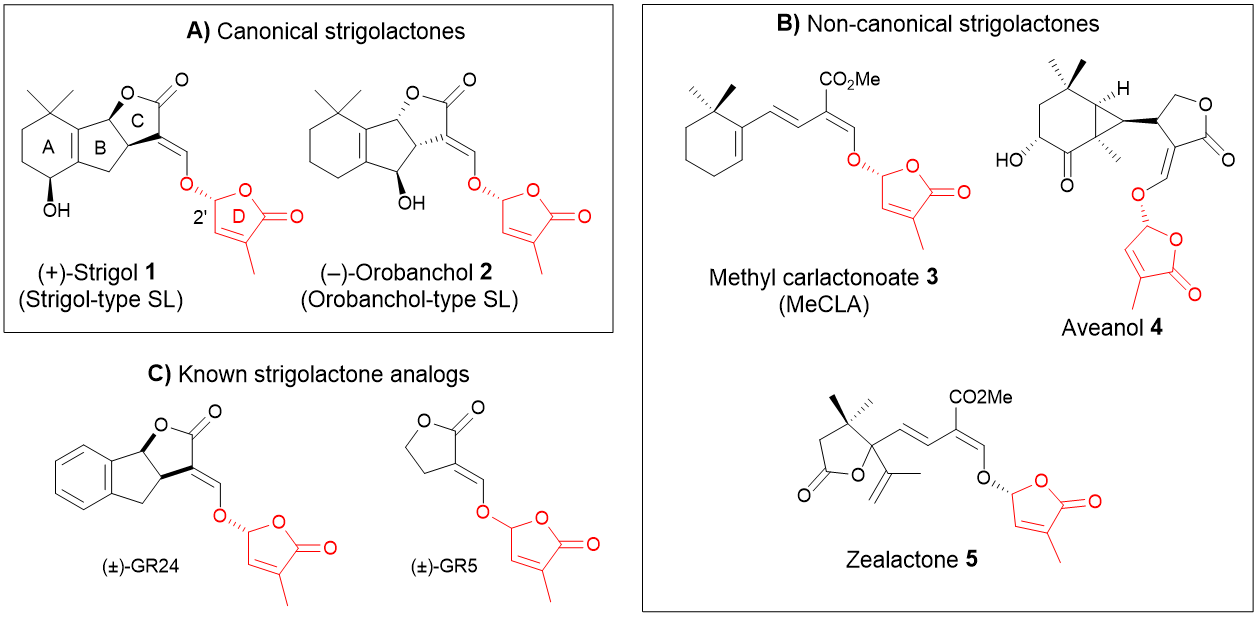
Strigolactones
Les strigolactones (SLs) constituent la classe d’hormones végétales la plus récemment découverte. Elles sont impliquées dans le contrôle de l’architecture aérienne et racinaire des plantes. Cette classe de molécules comprend les SL canoniques et les SL non-canoniques qui présentent une variété structurale beaucoup plus importante.
Nous avons développé jusqu’à présent des synthèses de SL canoniques et des analogues présentant des activités biologiques spécifiques.
Nous nous concentrons actuellement sur la caractérisation et la synthèse de nouvelles SL non canoniques (coll. LBPV Université de Nantes, IJPB INRA Versailles, BioCIS Chatenay-Malabry). Compte tenu de leur importance biologique, de leur très faible biodisponibilité, de leurs architectures moléculaires complexes et de leurs stéréochimies indéfinies, ces molécules constituent des cibles de choix pour la synthèse totale.
Analogues de glycolipides
Les signaux symbiotiques lipo-chitooligosaccharides (LCO) sont les facteurs Nod et LCO Myc pour les symbioses rhizobia-légumineuses et mycorhiziennes arbusculaires, qui sont les deux principales relations symbiotiques importantes sur le plan écologique entre les plantes supérieures et les micro-organismes. Ces molécules perçues par les plantes hôtes sont nécessaires à la mise en place d’une association performante. Nous nous intéressons à l’accès à ces structures complexes qui reste un défi pour le glycochimiste.

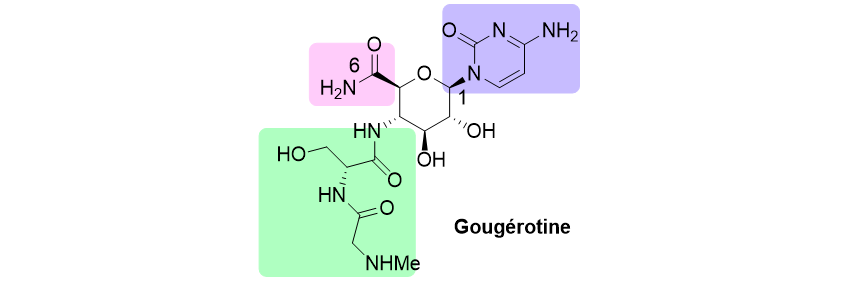
Analogues de la gougérotine
Nous étudions également la synthèse de nouveaux analogues de la gougérotine afin d’en étudier leur activité antifongique et antibactérienne. Ces peptido-nucléosides sont les représentants d’une large classe de produits naturels qui inhibent la synthèse de protéines en se liant à l’ARN, avec pour conséquence une activité antimicrobienne. Ce travail propose de mieux cerner la relation entre les sous-structures de la molécule et l’activité biologique. Les modifications concernent plus particulièrement la modification de la base nucléique ainsi que le remplacement la fonction carboxamide.